
树兰文化
第二届树兰医学青年奖获奖者:徐彦辉教授
2016-03-04

[教育和科研经历]
徐彦辉(1977.03 — ),教育部“长江学者”特聘教授、国家杰出青年基金获得者。生于辽宁省海城市。2004年毕业于清华大学,理学博士。徐彦辉研究员长期从事表观遗传调控关键蛋白的结构与功能研究,系统的阐明了DNA甲基化和组蛋白甲基化修饰(二者有密切关联并互相调节)关键酶的催化,底物识别和酶活性调节的分子机制,在表观遗传调控领域取得了突出成绩。他的研究成果发表在Nature、Cell、Mol Cell等高水平国际刊物上,近5年发表SCI论文30余篇,获得第二届“树兰医学奖青年奖”,“药明康德生命化学研究奖”,第八届“谈家桢生命科学创新奖”,“上海市青年五四奖章”,“明治生命科学奖”(杰出奖),上海市青年科技英才,“贝时璋青年生物物理学家奖”等多个奖项。
[主要学术贡献]
徐彦辉研究员主要从事表观遗传调控蛋白的结构与功能研究。近5年系统的阐明了DNA甲基化和组蛋白甲基化修饰(二者有密切关联并互相调节)关键酶的催化,底物识别和酶活性调节的分子机制,在表观遗传调控领域取得了突出成绩。
主持并承担了多项国家研究课题,包括科技部重大科学研究计划“973”项目,国家新药创制重大专项,国家自然科学基金重点项目、重大研究计划-集成项目和多项面上项目。获得第二届“树兰医学奖青年奖”,“药明康德生命化学研究奖”,第八届“谈家桢生命科学创新奖”,“上海市青年五四奖章”,“明治生命科学奖”(杰出奖),上海市青年科技英才,“贝时璋青年生物物理学家奖”等多个奖项。
主要学术成就和贡献包括:
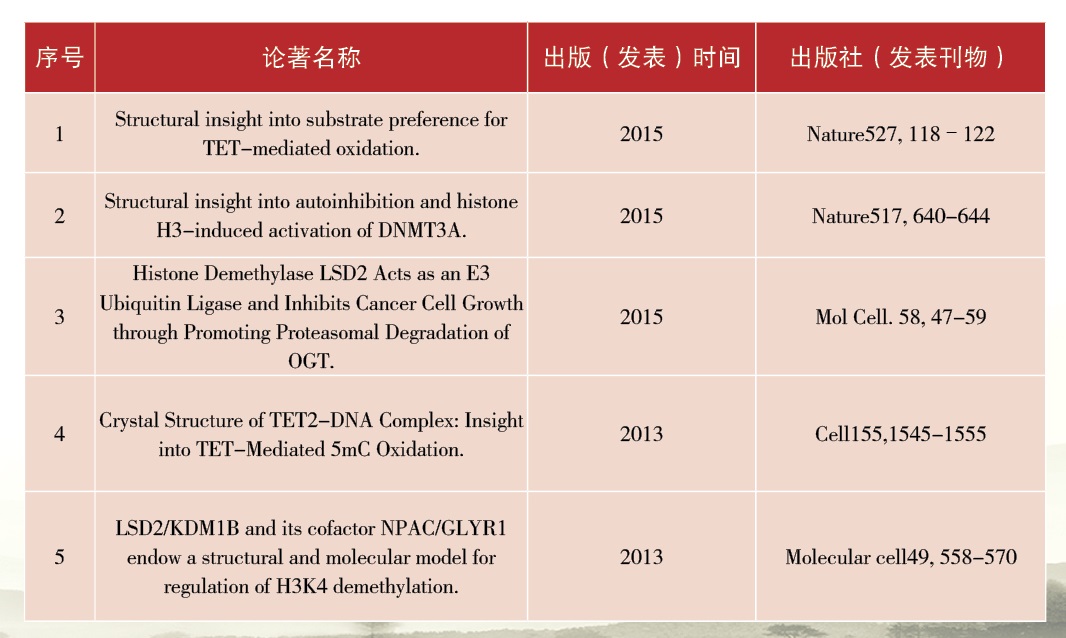
1、阐明了TET2催化及识别甲基化DNA底物的分子机制。首次报道了氧化DNA甲基化修饰关键蛋白TET2和DNA底物的复合物晶体结构阐明了TET蛋白识别DNA底物的分子机制,对DNA甲基化动态调控研究起到重要的推动作用。
2、阐明了组蛋白激活DNMT3A调节DNA甲基化建立的分子机制。阐明了UHRF1和DNMT1指导DNA甲基化维持的分子机制,揭示了UHRF1蛋白水平随细胞周期动态变化的机理。
3、阐明了组蛋白去甲基化酶的识别及活性调节机制。发现LSD2存在“双底物识别位点”,阐明NPAC蛋白激活LSD2酶活性的机制,发现LSD2具有E3泛素连接酶活性并抑制癌细胞生长。
近5年以通讯作者发表SCI收录论文20余篇,包括Cell(1篇),Nature(2篇),Mol Cell(2篇),Genes &Dev(2篇),Nature Communications(1篇),Proc Natl Acad Sci(1篇),Cell Research(6篇)等,并多次在国际学术会议上做大会报告。
[心路历程]
首先非常荣幸获得“树兰青年医学奖”,感谢树森兰娟院士人才基金会,尤其是郑树森院士,李兰娟院士对医学研究工作者的支持与鼓励。我人为这不仅是对我个人的奖励,更是对我们所在的课题组,以及我的合作者,甚至是我所从事的基础研究领域的认可。我还要感谢我的博士导师饶子和院士,博士后导师施一公院士,是他们带领我进入科学的殿堂并给我毫无保留的指导,支持和鼓励。我还要特别感谢我的家人,是他/她们多年了给了我无微不至的关怀和最大程度的支持,使我能够全身心的投入到科研工作中。
从1999年到现在,我一直从事结构生物学研究。1999年到2004年,我在清华大学生物科学与技术系攻读博士学位,师从饶子和院士。主要研究冠状病毒侵入细胞的分子机制和结构基础,利用生化和结构生物学手段,系统的研究了SARS等冠状病毒融和蛋白(Spike protein)的核心结构及其介导病毒入侵细胞的分子机制。2004-2008年,我在美国普林斯顿大学分子生物学系施一公教授的实验室博士后,集中研究了蛋白磷酸化酶2A(PP2A)的结构与其发挥功能的分子机制。2008初,我来到复旦大学生物医学研究院,组建独立课题组。主要从事表观遗传调控蛋白的结构与功能研究。
表观遗传是在不改变DNA序列的情况下发生的可遗传的基因组功能改变,主要包括DNA甲基化和组蛋白修饰,总称为表观基因组。生命的发育从胚胎开始,逐步分化为200多种不同的细胞类型,这个过程中基因组序列不变,改变的是表观基因组。每种细胞类型之间也是表观基因组不同,而细胞类型的维持需要表观基因组稳定的传递到子代细胞。在细胞命运改变,如人工诱导干细胞(iPS)和疾病的发生发展过程中,也涉及到表观基因组的改变。因此表观基因组在维持细胞类型和组织稳态中相对稳定,在发育和病理过程中又高度动态变化。可以说对表观遗传调控机制的理解,是我们认识基本细胞生命过程的基础。而结构生物学是表观遗传机制研究的有力武器,不仅可以给出关键蛋白的三维结构信息,为功能研究提供支持,也为相关的药物开发奠定重要的结构基础。
DNA甲基化是最重要的表观遗传修饰之一。哺乳动物DNA甲基化发生在胞嘧啶第五位碳原子上,称为5-甲基胞嘧啶,是重要的表观遗传修饰,调控基因转录,基因组印记,表观遗传等多种生物学过程,在发育过程中起关键作用。哺乳动物基因组的DNA甲基化主要发生在CpG二核苷酸。其建立是由DNMT3A/3B在胚胎发育早期完成的,而甲基化模式的维持是有DNMT1和UHRF1实现的。TET蛋白能够氧化5-甲基胞嘧啶成为5-羟甲基胞嘧啶,5-醛基胞嘧啶,5-羧基胞嘧啶,在DNA去甲基化过程中起关键作用。我们课题组选择上述这些蛋白质为研究对象,集中研究了她们的催化,底物识别和酶活性调节的分子机制,并设计小分子调节剂用于研究,开展用于临床的药物开发。
我们发现DNA甲基转移酶(建立DNA甲基化)DNMT3A存在活性的自我抑制状态,而这种抑制可以被组蛋白H3所解除。我们解析抑制态和激活态,两种状态的晶体结构,并开展生化研究 (Nature,2015a)。发现DNMT3A的ADD结构域结合催化结构域(CD),通过抑制CD与DNA底物的结合抑制其活性。组蛋白H3结合ADD结构域,破坏ADD与CD的结合,使CD能够接触底物,进而激活DNMT3A的活性,由此提出DNMT3A自我抑制及其被组蛋白激活的的分子机制模型。这一结果提示DNA甲基化主要发生在有组蛋白H3存在的核小体附近,并很好的支持了以往基因组测序结果,即组蛋白H3K4me3和DNA甲基化负相关。
TET 蛋白能够将5mC氧化为5-羟甲基胞嘧啶(5hmC),并继续催化5-hmC转化为5-甲酰胞嘧啶(5-fC)和5-羧基胞嘧啶(5-caC),在DNA去甲基化过程中起关键作用。哺乳动物TET蛋白在受精卵表观遗传重编程、多能干细胞分化、骨髓造血等关键生命过程中扮演着至关重要的角色,其失活也与多种疾病,尤其是血液肿瘤的发生密切相关。我们成功制备了TET2蛋白并解析了其与甲基化DNA的复合物结构 (Cell,2013)。结构分析和生化实验证明TET蛋白特异性识别CpG位点的DNA序列。 5mC通过碱基翻转的机制,被TET2从双链DNA中“撬开”,进而5mC翻出来并插入到催化口袋中,使5mC的甲基指向具有催化中心。该研究为TET蛋白介导的DNA甲基化动态调控机制提供了新视角,高分辨率TET2-DNA复合物结构的解析,也为靶向TET蛋白激活剂和抑制剂的研究奠定了结构生物学基础。
我们进一步研究发现,TET蛋白对三种DNA底物有明显的活性差异,就是对5mC的活性很高,而对5hmC,5fC的活性很低。我们解析了TET2与5hmC-DNA (1.80 Å),5fC-DNA (1.97 Å) 两种复合物的晶体结构。与TET2-5mC-DNA的晶体结构 (2.02Å)比较分析后发现:羟基,醛基因为受到分子间或分子内氢键作用,在催化中心指向不同方向,导致发生氧化的氢远离催化中心。在发生氧化反应中,5hmC、5fC不容易发生消氢作用,因此呈现活性低,而5mC中的三个氢原子可以指向催化的最优化方向(Nature, 2015b)。这一研究很好的证明了细胞内5hmC的水平远远高于5fC和5caC,说明5hmC,5fC相对稳定而不容易发生氧化反应。TET蛋白更容易产生5hmC。
在浩如烟海的人类知识当中,我们所做的努力显得微不足道。与众多前辈大师所作出的杰出发现相比,我们的成果更加显得渺小。作为一名普通的科研工作者,我只是希望努力做好本职工作,享受求索的过程,争取为人类的知识增加一点点。作为一个课题组长,学生的导师,我希望带好学生,带领他/她们步入科研的奇幻世界,并且以身作则,培养学生做合格的公民,优秀的科研工作者。
[代表性著作]
[获奖者徐彦辉教授风采]

[提名人]





