
树兰文化
第二届树兰医学青年奖获奖者:周荣斌教授
2016-04-05

[教育和科研经历]
周荣斌(1980.5.19-)生于湖南省衡阳市。1998年毕业于中国科学技术大学获生物学学士学位,2007年于中国科学技术大学获细胞生物学博士学位。2007-2011年在瑞士洛桑大学从事博士后研究。2011年3月入选中科院百人计划并被聘为教授和博士导师进入中国科学技术大学生命科学学院从事教学和科研工作。主要从事固有免疫受体信号转导及疾病机制研究,在NLRP3炎症小体活化和调控机制研究方面取得了多项研究成果,近5年来以第一作者在Nature、Nat Immunol,以通讯作者在Cell、Nat Immunol、Immunity、J Exp Med上发表多篇论文。
[主要学术贡献]
周荣斌教授主要从事固有免疫细胞转导机制,近年来在NLRP3炎症小体的活化、调控和疾病干预机制研究方面取得了多项研究成果,近5年来以第一作者在Nature、Nat Immunol,以通讯作者在Cell、Nat Immunol、Immunity、J Exp Med上发表多篇论文。研究成果被Nat Rev Immunol、Immunity、Nat Immunol等杂志多次评述和推荐,4项研究成果被F1000收录和推荐。 2011年入选中科院百人计划,2013年获基金委优秀青年基金项目支持,2015年入选教育部”长江学者“计划、获国家杰出青年基金项目支持并获第九届药明康德生命化学研究奖。主要学术成就和贡献如下:
一、发现NLRP3炎症小体在2型糖尿病中的致病作用:发现在Nlrp3 缺陷小鼠中,高脂食物诱导的葡萄糖耐受和胰岛素抵抗明显得到缓解,表明NLRP3炎症小体的异常活化是导致T2D相关的葡萄糖耐受和胰岛素抵抗的重要原因,从而提示炎症小体可能是治疗T2D的重要靶点。
二、鉴定NLRP3炎症小体活化的关键信号转导机制:(1)现线粒体损伤及其产生的活性氧在NLRP3炎症小体活化中的关键作用,提示可以靶向线粒体干预炎症性疾病; (2) 发现RNA病毒可以通过RIP1-RIP3-DRP1信号通路诱发线粒体损伤及NLRP3炎症小体活化,提示可以靶向RIP1-RIP3干预病毒性炎症。
三、揭示NLRP3炎症小体活化的关键负调机制:(1)发现Omega-3脂肪酸可以通过抑制NLRP3炎症小体活化缓解高脂食物诱导的T2D;(2)发现多巴胺能通过其受体DRD1抑制NLRP3炎症小体并改善系统性炎症。
[心路历程]
炎症是机体在遇到病原微生物感染或者发生损伤时的一种自我保护反应,有助于清除病原微生物和损伤的修复。然而,炎症反应失调,比如过度放大或者持续存在也会导致组织器官的损伤并参与多种人类重大疾病的发生过程,比如关节炎、神经退行性疾病、动脉粥样硬化、肿瘤等。NLRP3炎症小体是由细胞内固有免疫识别受体NLRP3、接头蛋白及蛋白酶caspase-1形成的一个胞内蛋白复合物,能够诱导IL-1b、IL-18等促炎因子的成熟和分泌,因而在炎症反应的发生过程中其非常关键的作用。另外由于NLRP3能够识别多种形态、结构和分子序列完全不同的模式分子,因而参与多种重要疾病的发生过程。我过去几年的研究一直集中在探究NLRP3炎症小体的活化、调控和疾病机制方面。
2007年博士毕业后我加入瑞士洛桑大学Jurg Tschopp教授实验室从事博士后研究工作。Jurg Tschopp教授是炎症小体的发现者和奠基人,我进入实验室后也从事炎症小体方面的工作,主要探究NLRP3炎症小体的致病机制和活化机制。在瑞士的四年时间里主要取得了两项研究成果。首先我的工作发现NLRP3炎症小体会促进高脂食物诱导的2型糖尿病的发生过程,Nlrp3缺陷能够抑制高脂食物诱导的代谢紊乱,包括血糖升高、胰岛素抵抗等症状。该项工作首次揭示了NLRP3在2型糖尿病发生中的关键作用,研究成果发表在2010年的Nat Immunol杂志上。工作发表之后的两年时间里Nat Immunol和Nat Med等杂志连续发表了多篇研究论文验证了NLRP3炎症小体能够促进2型糖尿病的发生。我在瑞士期间的另外一项工作是发现NLRP3炎症小体的活化依赖于线粒体的功能失调。我们的工作发现NLRP3炎症小体之所以可以识别多种病原微生物感染或者危险信号是因为NLRP3可以感知线粒体损伤和线粒体活性氧的产生。该项工作提示可以靶向线粒体来干预炎症反应和炎症性疾病。论文发表于2011年的Nature杂志上,目前论文已经被包括Nature、Science在内的杂志他引700余次。
在完成博士后训练之后我于2011年入选中科院百人计划加入中国科学技术大学生命科学学院从事教学和科研工作。回国之后我的一个主要研究方向就是探究NLRP3炎症小体的免疫生物学和疾病干预机制。一方面我们继续研究NLRP3是如何活化的。我们一项工作发现在RNA病毒感染过程中,NLRP3炎症小体的活化依赖于细胞坏死相关的RIP1-RIP3蛋白复合物。由于在急性病毒感染过程中炎症反应是致死的重要原因,我们的研究提示可以靶向RIP1-RIP3蛋白复合物来干预病毒感染诱导的炎症性疾病。该项工作发表于2014年的Nat Immunol上,并被Nat Immunol作为亮点推荐。
由于NLRP3炎症小体参与包括2型糖尿病在内的多种人类重大疾病的发生过程,那么机体必然存在负调机制避免NLRP3炎症小体的过度活化和疾病的发生过程。我们的工作揭示了炎症小体的两个关键的负调机制。首先我们发现食物成分Omega-3脂肪酸可以很好地抑制NLRP3炎症小体的活化,并且可以通过对NLRP3炎症小体的抑制缓解高脂食物诱导的2型糖尿病。该项工作的意义在于:1)揭示了omega-3脂肪酸的抗炎机制;2)证明可以通过小分子化合物抑制NLRP3炎症小体来干预炎症性疾病的发生过程。该项工作发表于Immunity杂志上,并被包括Immunity、Nat Rev Immunol等多个杂志作为亮点推荐。既然食物等外源性物质可以干预NLRP3炎症小体的活化,那么机体是否存在内源性的NLRP3炎症小体负调机制呢?我们接下去的研究发现神经递质多巴胺可以负调NLRP3炎症小体的活化,并且还可以通过对NLRP3炎症小体的调控缓解神经炎症和外周炎症。该项研究的意义在于不仅揭示了一种NLRP3炎症小体的内源性调控机制,还表明可以靶向多巴胺信号通路干预炎症性疾病。论文发表于2015年的Cell杂志上。
总之我近年来的研究集中探究NLRP3炎症小体的活化调控机制及靶向NLRP3炎症小体的干预策略。这些研究成果不仅有助于了解炎症和炎症性疾病的发生机制,还能为相关疾病的治疗提供潜在的干预靶点。
在接下去的研究当中我们将主要关注两点:1)探究NLRP3炎症小体关键的活化机制。由于NLRP3能够感知多种刺激信号,对其机制的探究有助于揭示免疫识别和信号转导的基本规律,获得理论上的突破和进展。2)筛选和鉴定靶向NLRP3炎症小体的小分子化合物,获得能够对NLRP3相关疾病进行干预的候选药物。
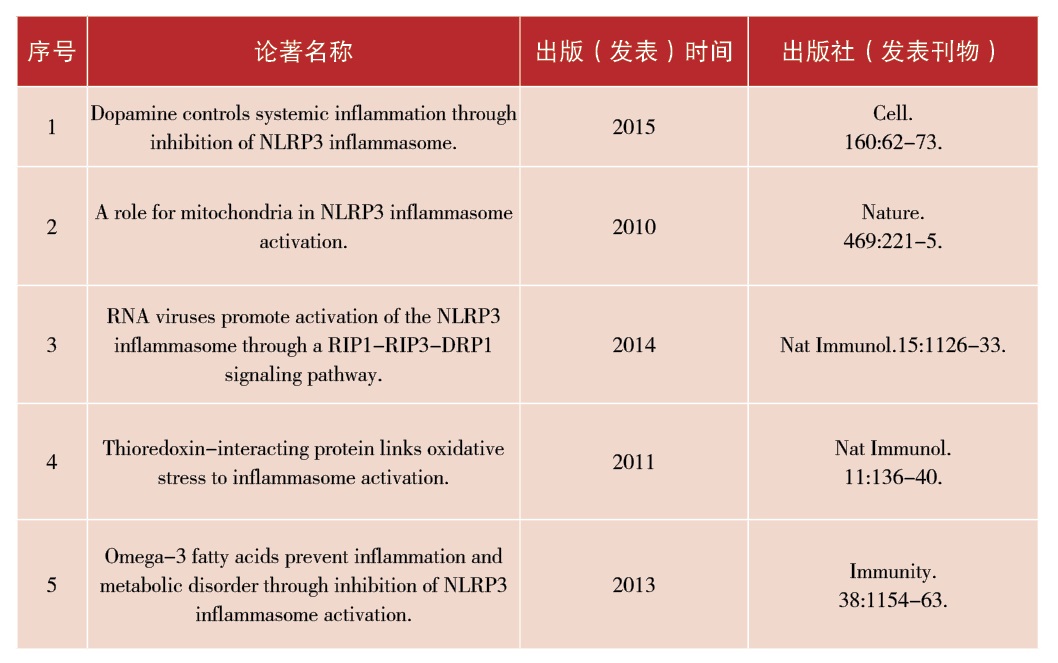
[代表性著作]
[获奖者周荣斌教授风采]

[提名人]





